
DEA Université Pierre et Marie Curie - PARIS 6
Océanologie, Météorologie et Environnement
Option Chimie et Géochimie marines

|
|
DEA Université Pierre et Marie Curie - PARIS 6 Océanologie, Météorologie et Environnement Option Chimie et Géochimie marines |
|
Modélisation biogéochimique
du lagon de Nouméa
Influence de la boucle microbienne
Vincent FAURE
Tuteurs de stage : Christel PINAZO1 et Jean-Pascal TORRETON2
|
1 Station Marine d’EndoumeLaboratoire d’Océanologie Biologique Rue Batterie des Lions 13007 Marseille |
2 Centre IRD de NouméaBP A5 98848 Nouméa – Nouvelle Calédonie |
Juin 2002
Résumé
Dans le milieu oligotrophe du lagon de Nouméa, la détermination des facteurs de contrôle des bactéries, ainsi que leurs interactions écologiques au sein du réseau trophique, sont essentielles à la compréhension des flux biogéochimiques (Jurgens et al., 2000).
L’objectif de cette étude est l’intégration de la boucle microbienne dans le modèle biogéochimique existant. Cette intégration a été réalisée dans le cadre d’un modèle sans dimension.
Les nouvelles variables et les nouveaux processus ont été déterminés à partir des mesures effectuées sur le lagon. Deux nouveaux compartiments ont été ajoutés : la Matière Organique Dissoute (COD et NOD) et les bactéries (carbone et azote bactériens). La production bactérienne est calculée à partir d’un modèle à stoechiométrie variable ; elle n’est limitée que par l’azote. Un travail préalable a en effet montré qu’il est le premier élément potentiellement limitant. Les excrétions du zooplancton et du phytoplancton ont été affinées afin de mieux simuler les processus de reminéralisation.
Les simulations de ce modèle sans dimension, réalisées en deux stations du lagon durant les mois d’Avril et Mai 2002, ont montré que le modèle se stabilise pour atteindre un équilibre entre les processus biogéochimiques, fonctionnant sur le principe de la régénération.
La comparaison des variables simulées avec les données de terrain pour la même période ont permis de mettre en évidence les limites du modèle. Le forçage physique important dans le lagon implique l’utilisation d’un modèle couplé physique-biogéochimique. Les processus impliquant la matière organique dissoute et la croissance du phytoplancton devront également être améliorés.
Les travaux régulier en cours sur le lagon constituent ainsi une excellente opportunité de coupler modélisation et expérimentations. L’expérimentation permet de combler les insuffisances de la paramétrisation. En retour, la modélisation permet de mettre en évidence les processus clefs, nécessaires à la compréhension du fonctionnement global du système.
Mots-clés : Modélisation, expérimentation, boucle microbienne, bactérie, lagon, Nouméa.
Abstract
In the Noumea Lagoon oligotrophic area, determining the controlling factors of planktonic bacteria and their ecological interactions within the microbial food web is essential to understand the biogeochemical oceanic fluxes (Jurgens et al., 2000).
This work is aimed at including the microbial loop in the existing biogeochemical model. We used a zero dimension model in order to reach this objective.
The new variables and processes were assessed from the data taken on the lagoon. Two compartments have been added: Dissolved Organic Matter (DOC and DON) and Bacteria (bacterial carbon and nitrogen). The bacterial production is derived from a variable stoichiometry model ; it is limited by nitrogen only. Indeed, previous measurements showed that nitrogen is the first potentially limiting nutrient. Excretion of zooplankton and phytoplankton were refined in order to simulate the processes of remineralisation in a better way.
Simulations of this 0D model, in two locations of the lagoon during April and May 2002, showed that the model becomes stable, and reaches a balance between the biogeochemical processes, based on regeneration. The comparison between the simulated variables and the data measured during the same period highlighted the limits of the model. Significant physical forcing in the lagoon implies the use of a physic-biogeochemical coupled model. The processes implying the dissolved organic matter and the phytoplankton growth also have to be improved.
Regular studies in progress in the lagoon provide therefore an excellent opportunity to couple modeling and experiments. Experimentation fills the gap of parameterization. In return, modeling highlights the key processes, necessary to the comprehension of the system dynamic.
Keywords : modelling, experimentation, microbial loop, bacteria, lagoon, Noumea.
SOMMAIRE
1. Introduction *
1.1. Cadre scientifique
*1.2. Problématique
*1.3. Cadre géographique
*1.4. Objectifs du DEA, moyens mis en śuvre
*2. Matériels et méthodes *
2.1. Description du modèle biogéochimique initial
*2.2. Ajout de la boucle microbienne
*2.2.1. Hypothèses
*2.2.2. Biomasse bactérienne
*2.2.3. Excrétions
*2.2.4. Matière organique dissoute, ammonium, et matière détritique
*2.2.5. Sensibilité du nouveau modèle
*2.3. Echantillonnages et mesures
*2.3.1. Stratégie d’échantillonnage
*2.3.2. Mesures bactériennes
*2.3.3. Eléments nutritifs, chlorophylle, production primaire
*3. Résultats *
3.1. Mesures de terrain, pour les mois d’Avril et Mai 2002
*3.1.1. Conditions initiales du modèle
*3.1.2. Conditions climatiques des mois d’Avril et Mai 2002
*3.1.3. Eléments nutritifs et variables biologiques
*3.2. Simulation en M33
*3.2.1. Nouveau modèle
*3.2.2. Modèle initial (sans boucle microbienne)
*3.3. Simulation en N12
*3.4. Simulation fictive – Rôle de l’azote organique dissous
*4. Discussion *
4.1. Comportement du modèle
*4.2. Comparaison avec le modèle initial
*4.3. Comparaison avec les mesures de terrain
*5. Conclusion et perspectives *
6. Bibliographie *
Les états insulaires du Pacifique sont soumis à de profondes mutations économiques, et sont généralement le lieu de concentrations humaines importantes : ces deux aspects ont de fortes implications sur l'équilibre de l'environnement côtier. Le compromis entre ce développement économique et la gestion environnementale devient par conséquent un problème sensible dans ces régions. L’étude des effets anthropiques sur les zones côtières tropicales revêt donc une importance particulière, et nécessite une approche pluridisciplinaire, associant étude et modélisation des mécanismes de fonctionnement.
Le lagon de Nouvelle-Calédonie subit des perturbations environnementales d’origine anthropique qui sont principalement liées à l’urbanisation de la presqu’île de Nouméa et à l’exploitation minière (nickel essentiellement) à ciel ouvert (Labrosse et al., 2000). Le développement économique de l’île s’appuie en particulier sur le développement en cours de projets miniers. Certains de ces projets prévoient l’exploitation des latérites sur la base de nouveaux procédés d’extraction par lixiviation acide, dont les implications environnementales sont encore mal cernées. Le lagon de Nouméa se présente donc comme un site d’étude particulièrement intéressant puisque caractérisé par un écosystème tropical oligotrophe, soumis à des pressions anthropiques croissantes, dans une zone confinée par le récif barrière, limitant les échanges avec l’océan environnant.
Dans le cadre du Programme National Environnement Côtier (PNEC-Chantier Nouvelle-Calédonie), et du programme de valorisation ZoNéCo, il a été proposé de développer une approche de modélisation du fonctionnement de l’écosystème lagonaire en lien direct avec les analyses biogéochimiques complémentaires menées sur le terrain. Ce travail s’appuie sur les études environnementales menées depuis vingt ans et poursuivies actuellement dans le cadre de l’Unité de Recherche Camélia du centre IRD de Nouméa, et en particulier sur les premières étapes de modélisation biogéochimiques (Bujan, 2000 ; Bujan et al., 2000).
Ce stage de DEA s’inscrit donc dans le PNEC " Chantier Nouvelle Calédonie ", et a été mené en collaboration entre le laboratoire d’Océanographie et de biogéochimie du Centre d’Océanologie de Marseille (COM) et l’unité de Recherche Camélia. Le COM a permis d’apporter les compétences en modélisation, tandis que les analyses biogéochimiques et la connaissance du milieu lagonaire étaient fournis par le centre IRD.
Depuis 1999, le PNEC conduit des opérations sur le thème de la modélisation biogéochimique du lagon sud-ouest de Nouvelle Calédonie. Le choix s’est progressivement fixé sur un couplage entre un module biogéochimique et le schéma d'advection-diffusion du modèle de circulation 3D du lagon (Douillet, 1998) et ceci afin d’obtenir une analyse fine du fonctionnement d’un lagon dans les zones sensibles (en particulier les baies abritées), au cours d'événements caractéristiques (périodes de crues, coups de vent). Ces approches de modélisation permettent d'obtenir des informations à la fois synthétiques, explicatives et prédictives en particulier sur les différents forçages qui contrôlent les cycles biogéochimiques.
Les bactéries hétérotrophes constituent le principal stock de carbone dans la zone euphotique, et cette biomasse peut excéder largement celle du phytoplancton dans les situations les plus oligotrophes (Cho et Azam, 1988 ; Fuhrman et al., 1989). En effet, les réseaux trophiques seront différents suivant l’état trophique du système. Les milieux eutrophes sont dominés par le phytoplancton. Les milieux oligotrophes, dominés par le bactérioplancton, fonctionnent au moyen d’un recyclage important. Dans ce dernier cas, les bactéries hétérotrophes sont considérées comme des compétiteurs efficaces du phytoplancton pour les éléments nutritifs (Kirchman, 1994).
Ainsi, dans le lagon de Nouméa, généralement oligotrophe, déterminer les facteurs de contrôle des bactéries, ainsi que leurs interactions écologiques au sein du réseau trophique, est essentiel à la compréhension des flux biogéochimiques (Jurgens et al., 2000).
Le modèle, dans sa structure antérieure, ne prenait pas en compte la boucle microbienne. Son intégration apparaît donc comme une étape essentielle dans l’évolution du modèle.

Figure 1 : Lagon Sud-Ouest de la Nouvelle-Calédonie
La Nouvelle-Calédonie est située entre 18° et 23° Sud, et 164° et 167° Est.
Le site d’étude est le lagon Sud-Ouest (cf. Figure 1).
D’une superficie de 2000 km˛, il comprend le site urbain de Nouméa, et les zones estuariennes environnantes. L’alimentation en eau douce de cet environnement côtier se réalise principalement par les rivières des Pirogues, de Boulari, et de Dumbéa. La présence de la longue barrière récifale entraîne une intensification des relations entre le lagon et l’océan à l’Ouest, au niveau des 3 passes principales (Boulari, Dumbéa, Uitoé). La bathymétrie (moyenne de la zone environ 18m) est très hétérogène ; les baies, peu profondes, sont d’une profondeur moyenne de 10m, et sont soumises à une forte pression anthropique et terrigène. Les 3 chenaux, correspondant aux entailles dans le récif barrière, sont d’une profondeur comprises entre 10 et 50 m.
La Nouvelle-Calédonie est soumise à un régime tropical maritime, caractérisé par de faibles contrastes de température (moins de 8°C) entre la saison la plus chaude et la saison la plus froide. Deux régimes de vents prédominent : les vents d’Est ou Alizés de direction ESE et SE prépondérants toute l’année (70% de l’année, Bujan, 2000) et des coups d’Ouest plus occasionnels de direction NW et SW généralement associés au passage des perturbations (dépressions et cyclones). Ces vents conditionnent largement le renouvellement et la circulation des eaux lagonaires (Douillet, 1998). La régularité de ces vents provoque une homogénéisation de la colonne d’eau, et impose un temps de renouvellement court (9 jours avec un vent de SE (110°) de 8m/s, Bujan 2000, vitesse moyenne des alizés, Douillet et al. 2001)
Ces processus hydrologiques contribuent pour une large part à préserver le caractère oligotrophe du lagon, malgré l’anthropisation et l’eutrophisation.
Concrètement, ce stage de DEA a pour objectif principal d’analyser les données existantes, afin d’intégrer la boucle microbienne dans le modèle biogéochimique, et de tester l’intérêt des modifications apportées.
Dans un premier temps, le travail consiste à déterminer les processus principaux à mettre en śuvre dans le modèle, et à faire des choix concernant les variables dont on veut simuler l’évolution. Les choix concernent des processus tels que la croissance des cellules, les uptakes d’éléments nutritifs, le broutage, l’exudation phytoplanctonique, la mortalité. Les variables choisies sont les biomasses phytoplanctonique et bactérienne, les éléments nutritifs et les éléments détritiques.
Cette étude fut menée au sein du centre IRD de Nouméa, sur la base des connaissances rassemblées par les différentes unités de recherche sur le lagon de Nouméa.
Dans un second temps, le travail a porté sur l’implémentation dans le modèle des modifications décidées. Cette implémentation a été effectuée à l’aide du langage de programmation FORTRAN.
Afin d’écourter les temps de calcul très long du modèle à 3 dimensions, il a été décidé dans le cadre de ce stage de travailler sur un modèle sans dimension. Le modèle utilisé est donc uniquement biogéochimique, et représente l’évolution des différentes variables en un point donné du lagon, à une profondeur donnée en l’absence de tout forçage hydrodynamique.
Les différents paramètres et conditions initiales sont déterminés à l’aide des mesures effectuées régulièrement par l’unité CAMELIA sur le lagon SW de Nouvelle Calédonie.
Pour terminer, les résultats du modèle sont comparés aux valeurs mesurées dans le lagon, en deux stations. La station M33, située près de l’îlot Maître, peut être considérée comme représentative du lagon (ou chenal lagonaire). La station N12, située dans la baie de Sainte-Marie, a été choisie comme exemple d’un milieu côtier soumis à des pressions anthropiques fortes (rejet d’eaux usées).

Figure 2 : Stations du suivi saisonnier
La participation aux mesures a été une étape importante de ce stage, car elle a permis au modélisateur de connaître précisément le type de mesure réalisée, leur précision, leur interprétation, les moyens humains et matériels qu’elles nécessitent, et ainsi de ne pas perdre contact avec la réalité !
Figure 3 : Modèle biogéochimique initial (cf. Tableau 1 pour la légende)
Ce modèle biogéochimique est extrait du modèle couplé, à 3 dimensions, présenté pour la première fois par Pinazo et al. (1996), et appliqué au Nord-Ouest de la Méditerranée. Il fut par la suite repris par Bujan (2000), et appliqué au lagon Sud-Ouest de Nouvelle-Calédonie. La dernière formulation de ce modèle (Pinazo et al., 2001) constitue le point de départ de ce travail.
Le modèle est présenté sur la Figure 3. Il comprend 7 variables d’état, décrivant les cycles du carbone et de l’azote impliqués dans la production de phytoplancton. La structure choisie est de la forme PZND (phytoplancton - zooplancton - nutriments - détritus). Le zooplancton n’est pris en compte que sous la forme d’une population théorique, non différenciée et statique, et aucune variable d’état ne lui est associée.
Les 7 variables considérées (cf. Tableau 1) sont : le phytoplancton et la matière organique détritique, exprimés en concentrations de carbone et azote, les nutriments inorganiques dissous, exprimés en ammonium et nitrate, la concentration en oxygène dissous. Les processus impliqués sont : la croissance photosynthétique, la respiration et la lyse du phytoplancton, le broutage, l’excrétion et les fécès du zooplancton, la minéralisation du matériel détritique, la nitrification, l’uptake et la réduction du nitrate par le phytoplancton au moment de l’assimilation.
Le taux de croissance du phytoplancton est une fonction du taux de croissance maximal, dépendant de la température, d’un facteur de limitation par la lumière (photo-inhibition), et d’un facteur de limitation par les nutriments, d’après la formulation en quota cellulaire (Caperon et Meyer,1972a ; Tett,1987).
La particularité de ce modèle biogéochimique tient au quota cellulaire (rapport azote : carbone), qui permet la détermination de l’état nutritionnel des cellules à travers la comparaison de ce quota cellulaire phytoplanctonique avec le rapport de Redfield. Cet état nutritionnel est alors pris en compte dans le calcul du taux de croissance, à travers le facteur de limitation par les nutriments. Il est repris dans le calcul du taux d’uptake d’ammonium et de nitrates, qui ne dépend donc pas seulement de la concentration des nutriments dans l’eau.
La nitrification est une fonction de la température et de la concentration en oxygène dissous. Les autres paramètres, comme le broutage, la respiration, la mortalité, le taux de minéralisation sont considérés constants.
Le zooplancton n’est pas considéré comme une variable d’état, mais comme une fraction de la biomasse phytoplanctonique, dépendant de la fonction de broutage. Cette biomasse théorique conduira à l’établissement de la fonction d’excrétion du zooplancton.
Le calcul de l’activité photosynthétique nécessite le forçage du modèle par la radiation photosynthétique disponible (P.A.R.), qui est déterminée à partir des données météorologiques d’irradiance solaire. Le dioxyde de carbone est considéré comme non-limitant dans la colonne d’eau.

Figure 4 : Modèle biogéochimique, intégrant la boucle microbienne (cf. Tableau 1 pour la légende)
|
Variables d’état du modèle |
|
|
CB |
Carbone phytoplanctonique |
|
NB |
Azote phytoplanctonique |
|
CBA |
Carbone bactérien |
|
NBA |
Azote bactérien |
|
CP |
Carbone détritique particulaire |
|
NP |
Azote détritique particulaire |
|
COD |
Carbone Organique Dissous |
|
NOD |
Azote Organique Dissous |
|
NH4 |
Ammonium |
|
Nitrates |
Nitrates |
|
O |
Oxygène |
Tableau 1 : Variables d'état du modèle
|
Croissance des bactéries |
||||
|
MUMAX_BA , le taux de croissance maximal des bactéries |
Exp |
0.13 h-1 |
Données Torréton 2000-2002 |
|
|
UPNHMAX_BA, l'uptake maximum d'ammonium par les bactéries |
Exp |
3,52E-6 molN/molC/s |
Rapport PNEC 2001 |
|
|
UPNODMAX_BA, l'uptake maximum de NOD par les bactéries |
Exp |
3,52E-6 molN/molC/s |
||
|
KNH_BA, la constante de demi-saturation pour l'uptake d'ammonium |
Exp |
10nmol.l-1 |
Données Torréton 2000-2002 |
|
|
KNOD_BA, la constante de demi-saturation pour l'uptake de NOD |
Exp |
10nmol.l-1 |
||
|
COEFF_UP : le coefficient de partage entre l'uptake d'ammonium et de NOD |
Litt |
0,208 |
Harmon et al. (1997) |
|
|
UP_PART : pourcentage de bactéries consommant de la MOP |
Exp |
5% |
Données Torréton 2000-2002 |
|
|
G_BA : le broutage des bactéries par le zooplancton, fonction de la production |
Exp+litt |
100% |
Jacquet (2001) ; Strom (2000) |
|
|
Quota cellulaire des bactéries |
||||
|
CBA_CELL, carbone bactérien dans une cellule |
Litt |
12,4 fg C .cell-1 |
Fukuda et al (1998) |
|
|
QMAX_BA : le quota cellulaire N/C maximal pour les bactéries |
Litt |
0.35 molN/molC |
Heldal et al (1996) |
|
|
QMIN_BA : le quota cellulaire N/C minimal pour les bactéries |
Litt |
0.12 molN/molC |
||
|
QMEAN_BA : quota cellulaire N/C moyen pour les bactérie |
Litt |
0,24 molN/molC |
||
|
Excrétions du zooplancton et phytoplancton |
||||
|
EXU_PHY : exudation par le phytoplanction de COD |
Litt |
6% |
Baines & Paces (1991) Bender et al. (1999) |
|
|
D_C, le coefficient d'assimilation en carbone |
Litt |
92% |
Gerber & Gerber (1979) Le Borgne et al. (1989) Le Borgne & Binet (1996) |
|
|
D_N, le coefficient d'assimilation en azote |
Litt |
95% |
||
|
K2_C, le coefficient d'utilisation de la nourriture assimilée en carbone (rendement net de croissance) |
Litt |
0,24 |
Gerber & Gerber (1979) Le Borgne et al. (1989) Le Borgne & Binet (1996) Le Borgne et al. (1997) |
|
|
K2_N, le coefficient d'utilisation de la nourriture assimilée en azote (rendement net de croissance) |
Litt |
0,445 |
||
|
EXU_NH_ZOO, la part d'excrétion d'ammonium par rapport au NOD |
Litt |
50,42% |
Le Borgne & Binet (1996) Le Borgne et al. (1997) |
|
|
R_ZOO, la respiration du zooplancton(/exudation totale de carbone) |
Litt |
31% |
Dagg (1976) Kremer (1978) Copping & Lorenzen (1980) Le Borgne et Roger (1983) Small et al. (1983) Lynch et al. (1986) Steinberg et al. (2000) |
|
Tableau 2 : paramètres du modèle. Exp : Données expérimentales sur le lagon de Nouméa. Litt : données issues de la littérature.
Le nouveau modèle, intégrant la boucle microbienne, est représenté sur la Figure 4. Les éléments représentés en rouge constituent les nouveautés apportées au modèle.
Quatre nouvelles variables d’état ont été créées : la biomasse bactérienne, exprimée en concentration de carbone et d’azote, la matière organique dissoute, exprimée en carbone et azote dissous.
Les nouveaux processus associés sont alors : la production bactérienne, l’uptake de matière organique dissoute et d’ammonium, la dégradation de la matière détritique particulaire et son uptake par les bactéries, le broutage des bactéries, l’exudation de COD par le phytoplancton, l’excrétion d’ammonium, de NOD et de COD par le zooplancton.
L’ensemble des paramètres du modèle est répertorié dans le Tableau 2. L’ensemble des scripts FORTAN de ce nouveau modèle est fourni en annexe de ce rapport.
L’établissement des équations représentant l’évolution de la biomasse bactérienne hétérotrophe et le choix des variables d’états impliquent un certain nombre d’hypothèses, résultant de l’analyse des variables bactériennes du lagon de Nouméa et, à défaut, de la littérature.
La principale hypothèse concerne la limitation par l’azote. Cette hypothèse est issue de 4 arguments :
 Figure 5 : Effets d’enrichissements après 48h en N-NH4 (vert), P-PO4 (bleu), C-Glucose (gris) et N+P (rayés) comparés aux contrôles (blanc) en 3 stations du lagon de Nouméa. A gauche : Production bactérienne (pM TdR/h), à droite : Chlorophylle a (µg/l). Les barres d’erreurs représentent les erreurs standard sur des réplicats (novembre 2000, Torréton et al. non publié).
Figure 5 : Effets d’enrichissements après 48h en N-NH4 (vert), P-PO4 (bleu), C-Glucose (gris) et N+P (rayés) comparés aux contrôles (blanc) en 3 stations du lagon de Nouméa. A gauche : Production bactérienne (pM TdR/h), à droite : Chlorophylle a (µg/l). Les barres d’erreurs représentent les erreurs standard sur des réplicats (novembre 2000, Torréton et al. non publié).
Ces 4 arguments suggèrent que l’azote est bien le premier élément potentiellement limitant dans le lagon Sud-Ouest de Nouvelle-Calédonie. Intégrer le phosphore dans le modèle comme variable d’état ne s’impose donc pas dans l’immédiat. En outre, les bioessais ont également montré que le carbone n’était pas limitant.
Dans ce modèle, la croissance des bactéries ne sera donc limitée que par l’azote.

Figure 6 : Temps (h) de turn-over du phosphate en fonction des temps de turn-over de l’ammonium à différentes stations du lagon de Nouméa (triangles : novembre 2000, ronds : juillet 2001). La droite représente l’égalité (Torréton et al. non publié).
La deuxième hypothèse porte sur le contrôle de la biomasse bactérienne. Celui-ci peut s’effectuer de deux manière différentes : un contrôle ascendant (" bottom-up "), principalement par
les substrats organiques et inorganiques, ou descendant (" top-down "), principalement par la prédation.Différentes études ont montré que la croissance des bactéries et les pertes par prédation dans les systèmes océaniques oligotrophes sont probablement équilibrées (Weisse, 1989 ; Landry et al, 1995 ; Goosen et al, 1997 ; Caron et al, 1999). Ce contrôle par la prédation est également confirmé par des expérimentations d’additions de substrats, au cours desquelles les biomasses bactériennes restaient à peu près constantes, malgré une forte augmentation de la production bactérienne (Kirchman, 1990 ; Kirchman et Rich, 1997). Enfin, Strom (2000) a répertorié 17 études qui ont mesurées simultanément la production bactérienne et le broutage bactérien. Dans le cas des eaux de faible production, cette compilation montre l’équilibre entre prédation et production bactérienne.
Un travail précédent sur le lagon de Nouméa (Jacquet, 2001) montre que les productions bactériennes varient jusqu’à un facteur 68 en fonction des conditions trophiques (entre le fond de la baie de Sainte-Marie et le chenal lagonaire), alors que l’abondance bactérienne ne varie que d’un facteur 2,5 au maximum. Ceci suggère également un contrôle descendant étroit sur les bactéries, très probablement par la prédation.
Cette analyse de la littérature et des mesures sur le lagon nous ont par conséquent conduit à équilibrer la production bactérienne avec le nombre de bactéries broutées. La biomasse bactérienne sera donc constante au cours du temps.
Il convient de noter enfin que les infections virales peuvent être un facteur important de perte bactérienne. Selon Fuhrman (1999), les virus peuvent être responsable de 10 à 50% de la mortalité des bactéries dans les eaux de surface. Cependant, le manque de précision de ce facteur de mortalité, ainsi que l’absence de données sur le milieu étudié, nous ont conduit à ne pas intégrer les pertes par lyse virale dans le modèle.
Modèle de DROOP
Afin de conserver la cohérence du modèle global, nous avons choisi de représenter la biomasse bactérienne à l’aide des concentrations en azote et carbone bactérien, et de calculer leur évolution temporelle à partir du concept de quota cellulaire (Q). Ce concept (le modèle de Droop) considère que le taux de croissance, µ, est une fonction des nutriments limitants à l’intérieur des cellules. Il n’existe alors aucune relation directe entre ce taux de croissance et la concentration extracellulaire des substrats. Le quota cellulaire permet de construire des modèles à stoechiométrie variable.
Panikov (1995) avait critiqué ce modèle, argumentant que la relation µ=f(Q) n’est pas une relation aussi fondamentale que celle liant µ et les substrats. Cet argument est juste dans le cas de croissance à l’état stationnaire, mais durant des phases transitoires de croissance, cette relation entre µ et les nutriments ne doit pas être aussi directe, et le modèle en quota cellulaire se justifie (Heldal et al, 1996).
Le modèle de quota cellulaire utilisé ici est semblable à celui utilisé par Thingstad (1987) en microcosmes, mais on ne considère ici qu’une seule limitation possible, la limitation par l’azote.
Des quotas cellulaires ont été calculés par Heldal et al. (1996), à l’aide d’une technique de microanalyse aux rayons X. L’étude de ces données à l’aide d’un modèle de Droop a permis de fixer la gamme de valeurs possibles pour différents rapports, en particulier le rapport N : C (cf. Tableau 2).
La croissance des bactéries étant considérée comme non limitée par le carbone (voir plus haut), nous avons donc considéré que le carbone contenu dans une cellule bactérienne est constant (cf. Tableau 2), ce qui permet de s’affranchir d’une variable représentant le nombre de bactéries.
Croissance des bactéries
![]()

![]()
![]() , (Del Giorgio et Cole, 1998)
, (Del Giorgio et Cole, 1998)
avec :
CBA est une biomasse carbonée bactérienne, et non un quota cellulaire. BP est une production nette, c’est pourquoi la respiration ne rentre pas en jeu dans l’évolution de CBA. Cependant, BR est calculée afin de déterminer la quantité totale de carbone qui a été nécessaire pour la croissance des bactéries. Ce calcul est réalisé à l’aide d’une relation liant BR et BP mise en évidence sur une large gamme de données issues de la littérature (Del Giorgio et Cole, 1998). Trois déterminations de l’efficacité de croissance bactérienne, pour des conditions trophiques différentes du lagon de Nouméa, montrent que cette relation semble applicable dans ce milieu (données non publiées).
Le taux de croissance maximal correspond à la croissance maximale possible des bactéries. La valeur (0,13h-1) de ce paramètre est issue à la fois :
![]()
![]()


avec :
L’uptake de nutriments organiques (Williams, 2000) et inorganiques (Kirchman, 2000) par les bactéries est un sujet largement débattu.
Pour les nutriments organiques, les modèles incluant la boucle microbienne différencient généralement deux types de substrats (monomère ou polymère), impliquant une étape supplémentaire, l’activité exoenzymatique, avant l’assimilation par les bactéries (Billen, 1991). Les travaux considérant cette étape font référence, soit à des mesures d’activités exoenzymatiques, généralement limitées aux activités exoprotéolytiques (Billen, 1991), soit à un coefficient de partage – assez arbitraire – entre uptake des monomères et hydrolyse des polymères dans la consommation totale de matière organique (Billen, 1991).
Faute de mesure d’activités exoenzymatiques dans le lagon de Nouméa, nous avons préféré nous baser sur les grandeurs mesurées dans le milieu étudié. Les substrats sont donc uniquement l’azote organique dissous et l’ammonium. Les uptakes de ces éléments suivent une loi du type Michaelis-Menten, pondérée par la formulation en quota cellulaire.
Cependant, on considère qu’une partie (UP_PART) des nutriments provient de la dégradation par les bactéries de la matière détritique particulaire. Cette partie est supposée être proportionnelle à la fraction de la production bactérienne réalisée par les communautés attachées aux particules (e.g. retenue sur membrane de porosité 1 µm). La demande total en azote est représentée par UP_BA. On retire alors des uptakes de NOD et d’ammonium une fraction UP_PART (facteur (1-UP_PART) dans les équations). Cette fraction sera alors prélevée sur l’azote détritique particulaire (cf. 2.2.4).
En ce qui concerne les nutriments inorganiques, le paramètre essentiel de ces équations est l’uptake maximal d’ammonium. Il a été évalué à partir de mesures d’uptake de 15NH4 dans la classe de taille bactérienne (<0,6 µm, Figure 7). Ces données montrent une corrélation significative entre uptake maximal de NH4 (en molN/h) et production de biomasse bactérienne (incorporation de thymidine ou TdR en mol TdR/l/h). Afin d’obtenir l’uptake maximal de NH4 en fonction du temps, cet uptake spécifique est multiplié par le taux de croissance maximal des bactéries.
L’uptake maximal d’azote dissous est pris égal à celui de l’ammonium.
Bien que les bactéries puissent également incorporer des nitrates, trop peu de données sont disponible pour en estimer l’importance (Kirchman, 2000). Ce processus est donc négligé dans cette première approche.

Figure 7 : Uptake maximum de NH4 (nM/h) dans la classe de taille < 0,6 µm en fonction de l’incorporation de thymidine (pM/h) (Torréton, non publié). La filtration sur membrane Nuclepore de porosité 0,6 µm est faite après incubation. La pente est corrigée du pourcentage de bactéries retenues par la membrane 0,6µm, du coefficient de conversion de la TdR en nombre de cellules (Jacquet, 2001), et du contenu en azote par cellule (Fukuda et al. 1998). Barres d’erreurs = écart-types.
Compartiment zooplancton
Dans un premier temps, nous avions décidé de distinguer deux catégories de brouteurs (protistes et zooplancton). Cependant, il est très difficile d’obtenir des informations valables sur l’excrétion de ces brouteurs. D’autre part, on ne peut pas supposer que les protistes ne consomment que des bactéries hétérotrophes. Ceux-ci consomment également d’autres organismes des fractions pico- et nano-planctoniques dans des proportions qui restent à évaluer.
C’est pourquoi, nous regroupons ces deux types de brouteurs dans une seule entité, dont nous allons déterminer les paramètres.
Selon Le Borgne (1978, 1986), le métabolisme d’une cellule zoo planctonique peut être résumé de la manière suivante :
![]()
avec :
La totalité de la biomasse broutée, correspondant à l’ingestion totale du zooplancton, s’écrit :
![]()
On connaît la biomasse totale (phytoplancton + bactéries + matériel détritique), BTotal, ainsi que celle de chaque compartiment.
Nous considérons que les brouteurs ne choisissent pas un type particulier de nourriture. Ils sont opportunistes, c'est a dire qu'ils prélèvent leur nourriture au hasard en raison de leur mode de capture (filtration ou phagocytose). On peut alors écrire que l'ingestion de phytoplancton (Iphyto), de bactéries hétérotrophes (Ibact.) et de détritus (Idétritus.) sont proportionnelles à l'importance de ces éléments dans la biomasse particulaire.
L’ingestion de phytoplancton est connue, ce qui permet de calculer ITotal en fonction de Iphyto :
![]()
Les paramètres contrôlant le métabolisme du zooplancton sont (Le Borgne, 1978 ; Le Borgne, 1986) :
![]() ,
, ![]() ,
, ![]()
![]()
avec :
Chacun des paramètres ci-dessus est fonction de C,N,P, et varie suivant le milieu considéré.
L’excrétion totale (organique et minérale) s’écrit :
![]()
ou :
![]()
On peut alors écrire :
![]() ,
, ![]() ,
, ![]()
![]() ,
, ![]() ,
, ![]()
avec :
Notre but est de pouvoir quantifier les rejets d’ammonium, de COD, de NOD, et de matériel détritique dans le milieu. Les paramètres utilisés dans le modèle sont donc : EXU_NHzoo, Rzoo, K2 et D%.
Ces différentes relations permettront d’établir les équations de matière dissoute et d’ammonium.
Compartiment phytoplancton
Une synthèse récente (Nagata, 2000) sur l’exudation de matière dissoute par le phytoplancton, nous a amené à ne considérer que des rejets de Carbone Organique Dissous. En effet, bien que le phytoplancton puisse également excréter de l’azote organique dissous, trop peu de données existent dans la littérature pour en apprécier l’importance.
Nous avons choisi d’utiliser le concept de PER : Percent Extracellular Release, qui représente la fraction de COD exudée par rapport à la production primaire nette.
Une synthèse des données publiées conduit à calculer une valeur moyenne du PER pour les océans de 13% (Baines et Pace, 1991). A partir de cette valeur, Bender et al. (1999) ont alors calculé que l’excrétion de COD, pour le Pacifique, serait de 6% de la production brute. C’est cette valeur que nous utiliserons.
L’équation de la biomasse carbonée phytoplanctonique est alors modifiée de la manière suivante :
![]()
avec :
Matière organique dissoute
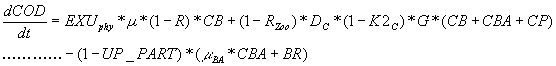
avec :
De la même façon que pour l’azote, on considère qu’une partie de la demande en carbone des bactéries est apportée par dégradation du matériel détritique particulaire. Cette fraction UP_PART est donc retirée de la consommation de COD par les bactéries. Elle sera prélevée sur le carbone détritique particulaire.
![]()
avec :
Ammonium
L’équation représentant l’évolution de l’ammonium, NH, a été modifiée pour prendre en compte les deux nouveaux processus ajoutés (exudation du zooplancton, et uptake des bactéries) :

avec :
Trois modifications sont apportées aux équations de la matière organique détritique.
La première consiste à prendre en compte l’uptake de ses produits de dégradation par les bactéries (cf. équation de la MOD pour le carbone, et le chapitre 2.2.2 pour l’azote).
La deuxième modification concerne l’excrétion de fécès par le zooplancton. D’après les équations du chapitre 2.2.3, ces fécès correspondent à la partie non assimilée, NA, de la matière organique totale ingérée par le zooplancton. On peut écrire :
![]()
D’où, à partir de la définition de D% :
![]()
Enfin, il est nécessaire de prendre en compte la consommation de la matière organique détritique par le zooplancton. D’après l’équation de l’ingestion totale du zooplancton (cf. chapitre 2.2.3), cette ingestion est égale à :
![]()


Les paramètres sensibles du modèle sont essentiellement ceux contrôlant les uptakes d’azote des bactéries :
Le modèle n’est pas sensible aux conditions initiales, à condition que les valeurs soient dans une gamme classique. La stabilisation de ce modèle 0D est indépendante des valeurs initiales des variables biologiques.
La modélisation est très demandeuse de données de terrain. Ces données nous permettent de déterminer les paramètres de nos équations, de fixer les conditions initiales des modèles, et de comparer l’évolution des variables simulées avec la réalité.
Ce stage de DEA a bénéficié des campagnes de mesure réalisées par l’équipe de microbiologie de l’UR CAMELIA.
Un suivi annuel des deux stations, nommées M33 et N12, a démarré début Avril, dans le cadre de la thèse de S. Jacquet et des travaux de JP Torréton. Ces deux stations sont présentées au paragraphe 1.4.
L’échantillonnage du suivi saisonnier est bimensuel durant le mois d’Avril, puis hebdomadaire à partir du mois de Mai. Bien que la colonne d’eau soit le plus souvent homogène en raison des vents réguliers, les prélèvements sont effectués en 5 profondeurs espacées régulièrement le long de la colonne d’eau de chaque station. Les prélèvements sont alors mélangés, afin d’avoir un échantillon représentatif de l’ensemble de la colonne d’eau.
Les opérations en mer ont été effectuées à bord du " Coris ", catamaran à moteur de l’IRD. Les prélèvements d’eau sont réalisés avec une bouteille NISKIN de 5 litres, préalablement lavée à l’acide.
Toutes les manipulations ultérieures sont effectuées dans de la vaisselle stérile jetable ou préalablement lavée à l’acide. Chacun de ces prélèvements était associé à des mesures par une sonde CTD équipée de capteurs additionnels (température, salinité, fluorescence, PAR, turbidité).
Les simulations de ce modèle 0D seront effectuées sur ces 2 stations, sur les mois d’avril et Mai.
Abondance bactérienne
L’abondance bactérienne est mesurée par microscopie à épifluorescence, après marquage de l’ADN bactérien avec un fluorochrome (DAPI, Porter & Feig, 1980).
Production bactérienne
L’activité bactérienne est estimée par incorporation de thymidine tritiée(TdR). Le protocole suivi est celui de Torréton et Dufour (1996). La thymidine tritiée (15 nM, concentration finale) incorporée après 1h d’incubation à température in situ est déterminée à l’aide d’un compteur à scintillation.
Si la mesure de l’incorporation de TdR est précise, reproductible et à fort taux d’acquisition, son interprétation en production bactérienne pose des difficultés. Dans un premier temps, il est nécessaire de convertir les moles de TdR en nombre de cellules produites ; les valeurs de conversion de la littérature sont très variables, c’est pourquoi le facteur utilisé a été calculé expérimentalement pour le lagon de Nouméa (Jacquet, 2001). Pour convertir ce nombre de cellules en carbone bactérien, un nouveau facteur de conversion intervient : la masse de carbone par cellule. La valeur la plus utilisée a été longtemps celle publiée par Lee et Fuhrman (1987) : 20 fgC/cellule ; nous avons préféré utiliser un facteur plus récent, celui de Fukuda et al. (1998) : 12.4 fgC/cellule.
La variabilité de ces facteurs de conversion conditionne l’interprétation des mesures. Il est important d’en avoir conscience et d’utiliser ces résultats avec précaution.
Eléments nutritifs
Les nutriments ont été mesurés par le laboratoire de Chimie Marine de l’IRD.
L’ammonium est mesuré par fluorimétrie (Kérouel et Aminot, 1997), à partir de triplicata (4 réplicats pour le suivi saisonnier).
Les mesures des nitrates (Raimbault et al, 1990) et phosphates (Murphy et Riley, 1962) sont réalisées à l’aide d’un Technicon, selon une méthode colorimétrique.
Chlorophylle
Les mesures sont réalisées par le laboratoire de Chimie Marine de l’IRD.
La chlorophylle a est déterminée par filtration sur membranes de différentes porosités, extraction des pigments au méthanol et dosage par fluorimétrie.
Les filtres utilisés sont en fibre de verre (Whatman GF/F de porosité nominale 0,7 µm, fraction totale), et en Polycarbonate (Nuclepore) de porosités 2 et 10 µm.
Production primaire
La production primaire est estimée par incorporation de 14C-bicarbonate (Steeman-Nielsen, 1951).
La mesure est réalisée en conditions " in situ simulées ", avec des flacons simulant différentes proportions d’énergie incidente (100, 50, 25, 12,5, 6,25 et 0%), situés dans un bac exposé à la lumière du jour pendant environ 6 h et à température in situ. La radioactivité assimilée retenue sur membranes (Whatman GF/F, et Nuclepore de porosité 2 µm et 10 µm) est mesurée à l’aide d’un compteur à scintillation. L’incorporation de carbone aux différents niveaux de lumière est placée aux profondeurs correspondantes déterminées par les profils de PAR. Les valeurs exprimées par m˛ sont obtenues en intégrant selon la méthode des trapèzes.
MOD et MOP
Les mesures de COD et NOD sont réalisées au moyen d’un auto-analyseur Shimadzu TOC-V par G. Cauwet à l’Observatoire Océanologique de Banyuls-sur-Mer.
Les mesures de carbone et azote organiques particulaires sont effectuées au moyen du PDZ Europa Carbon and Nitrogen IsotopeAnalyser Integra-CN, par P. Raimbault, au LOB de Marseille.
Les simulations du modèle seront effectuées sur une période de 2 mois (du 04/04/02 au 03/06/02), avec un pas de temps de 30 minutes, à une profondeur de 3m.
Les conditions initiales du modèle pour ces simulations seront déterminées à partir des mesures de la journée du 4 Avril (cf. Tableau 3).
|
Conditions initiales ( 4 Avril 2002) |
N12 |
M33 |
|
|
Température |
exp, °C |
25,7 |
25,6 |
|
NB_CELL_BA , concentration en cellules bactériennes |
exp, cell/l |
1,30E+09 |
1,00E+09 |
|
CBA_CELL, carbone bactérien par cellule (Fukuda et al., 1998) |
litt, mol C/cell |
1,03.1E-15 |
1,03.1E-15 |
|
Biomasse carbonée des bactéries |
litt*exp, µmolC/l |
1,339 |
1,03E+00 |
|
Biomasse azotée des bactéries (calculée à partir du QN/C initial) |
litt*exp, µmolC/l |
1,97E-01 |
1,24E-01 |
|
Production bactérienne |
exp, µmolC/l/s |
8,95E-06 |
7,34E-07 |
|
COD |
exp, µmol/l |
67,5 |
67,5 |
|
NOD |
exp, µmol/l |
7,91 |
5,32 |
|
Chlorophylle a |
exp, µg/l |
0,912 |
0,284 |
|
NH4 |
exp, µmol/l |
0,36 |
0,028 |
|
Nitrate |
exp, µmol/l |
0,123 |
0,021 |
|
CP |
exp, µmol/l |
11,24 |
12,18 |
|
NP |
exp, µmol/l |
1,06 |
1,76 |
Tableau 3 : Conditions initiales en M33 et N12. Exp : Données expérimentales sur le lagon de Nouméa. Litt : données issues de la littérature
La biomasse carbonée initiale (CBA) est calculée à partir des mesures d’abondance bactérienne et de la valeur du carbone bactérien d’une cellule (Fukuda et al., 1998).
La biomasse d’azote bactérien initiale est calculée à partir de cette biomasse carbonée et de la valeur du quota cellulaire QN/C initial. Ce quota cellulaire peut être déduit facilement de l’équation suivante lorsque l’on connaît la valeur mesurée de production bactérienne initiale BP et la biomasse carbonée CBA (cf. 2.2.2) :
 ,
, ![]()
Rayonnement
Les données de lumière, indispensables à la simulation de l’activité photosynthétique, sont fournies par Météo France Nouvelle Calédonie. Le rayonnement est exprimé en J/cm˛ pour une durée de 6min.
Le pas de temps du modèle étant de 30 min, nous avons intégré ces valeurs afin que le modèle dispose de la donnée exacte de rayonnement à chaque pas de temps.
 Les variations du rayonnement sont présentées sur la Figure 8.
Les variations du rayonnement sont présentées sur la Figure 8.
Figure 8 : Rayonnement total journalier à Nouméa, du 01/04/02 au 02/06/02 (données intégrées sur la journée et centrées sur 12h)
Vent
Les données de vent ne sont pas présentées ici. Elles ne sont pas nécessaires au fonctionnement du modèle sans dimension (strictement biogéochimique), mais la connaissance des conditions hydrologiques durant la période de simulation sera nécessaire pour l’interprétation.
Les alizés se sont maintenus durant les deux mois dans une gamme de 15 à 25 nśuds. Ce forçage est très important, et provoque une circulation importante des masses d’eau dans les lagons.
Les Figure 9 et Figure 10 présentent les variations des principales variables biologiques mesurées, ainsi que l’ammonium.
|
|
|
Figure 9 : Variations de la production bactérienne (106 cell/l/h) et de la chlorophylle a (µg/l) du 04/04/02 au 03/06/02, pour les stations M33 et N12.
La station M33 est très oligotrophe. Les concentrations en Chl a sont assez faibles, et la production bactérienne atteint des valeurs particulièrement faibles, en particulier le 07/05/02.
La station N12, du fait de sa situation géographique côtière, possède des valeurs plus fortes de Chl a et de production bactérienne, mais ces valeurs restent faibles pour le lagon.
|
a |
b |
Figure 10 : Variations de l’ammonium (µM/l) du 04/04/02 au 03/06/02, pour les stations M33 (a) et N12 (b). Barres d’erreurs : écart-types sur 4 réplicats.
Les résultats de la simulation sur la station M33 sont présentés sur les Figure 11, Figure 12 et Figure 13.
|
a |
b |
Figure 11 : Variations du carbone et de l’azote phytoplanctonique, pour la station M33. à gauche : simulation du 04/04/02 au 03/06/02 ; à droite : simulation du 04/04/02 au 06/04/02. CB et NB en µmol/l.
Le phytoplancton pousse en début de simulation, puis chute de manière régulière jusqu’à la fin (Figure 11-a). On peut cependant noter quelques oscillations sur la fin de la simulation. La Figure 11-b montre l’alternance jour-nuit de la croissance phytoplanctonique, résultant de la limitation en lumière.
|
a |
b |
Figure 12 : Simulations pour la station M33, du 04/04/02 au 03/06/02. A gauche : variations du carbone et de l’azote détritique ; à droite : variations de l’ammonium et de l’azote organique dissous (NOD). Toutes les variables sont exprimées en µmol/l.
La Figure 12-a met en évidence la forte décroissance de la matière organique détritique durant toute la simulation. Alors que NP se maintient à une valeur constante (0,2µmol/l) à partir du 11/04/02, CP s’annule à partir du 18/04/02.
L’azote organique dissous diminue régulièrement au cours de la simulation ; on peut cependant noter une légère augmentation au début de la simulation, entre le 04/04/02 et le 07/04/02 (Figure 12-b).
L’ammonium montre des variations importantes (Figure 12-b). Une nette augmentation s’observe durant le 1er jour de simulation, suivie puis une forte décroissance jusqu’au 11/04/02 (Figure 12-b). Du 11/04/02, et jusqu’à la fin de la simulation, on peut alors noter une augmentation régulière de l’ammonium, ponctuée par de petites oscillations.
|
a |
b |
Figure 13 : Simulations pour la station M33, du 04/04/02 au 03/06/02. A gauche : production bactérienne (106 cell/l/h) et chlorophylle a (µg/l) ; à droite : équivalent, mais " zoomé " sur la gamme de variations de la production bactérienne.
La production bactérienne part d’un niveau initial très faible, mais une très forte augmentation se produit durant le 1er jour de simulation (Figure 13-a ). La production se maintient ensuite à un niveau constant (environ 44,5 106 cell/l/h) durant toute la simulation. La Figure 13-b est un " zoom " centré sur cette valeur : elle met en évidence les petites variations de la production entre les valeurs 43,5 et presque 45 106 cell/l/h.
Afin de pouvoir évaluer les améliorations apportées par le nouveau modèle, nous avons effectué les mêmes simulations d’avril et mai 2002 avec le modèle initial ne comportant pas de boucle microbienne. Les résultats de la simulation à la station M33 sont présentées sur la Figure 14.
|
a |
b |
Figure 14 : Simulations avec le modèle initial pour la station M33, du 04/04/02 au 03/06/02. A gauche : variations du carbone et de l’azote phytoplanctonique ; à droite : variations de l’ammonium et de l’azote détritique particulaire. Toutes les variables sont exprimées en µmol/l.
Les figures Figure 14-a et Figure 14-b montrent que l’on retrouve la même dynamique globale dans les deux modèles.
Cependant, les valeurs du phytoplancton (CB et NB) sont globalement plus élevées dans le cas du modèle initial (Figure 14-a). L’azote organique détritique (NP) décroît régulièrement, et atteint des valeurs inférieures à son seuil de stabilisation (Figure 14-b).
Le pic d’ammonium observé dans le cas du nouveau modèle (Figure 12-b) se retrouve sur la Figure 14-b, avec une décroissance moins rapide qui se termine autour du 17/04/02 (au lieu du 11/04/02) ; l’augmentation qui s’ensuit est moins forte que dans le cas du nouveau modèle, mais les oscillations sont toujours présentes.
Pour la simulation de la station N12, les mêmes types de graphes que précédemment sont présentées sur les Figure 15, Figure 16, et Figure 17.
|
a |
b |
Figure 15 : : Variations du carbone et de l’azote phytoplanctonique, pour la station N12. à gauche : simulation du 04/04/02 au 03/06/02 ; à droite : simulation du 04/04/02 au 06/04/02. CB et NB en µmol/l.
La dynamique du phytoplancton à la station N12 est très proche de celle observée en M33 (Figure 15-a). Cependant, les valeurs du carbone et azote phytoplanctonique sont plus élevées en N12, en raison des conditions initiales en éléments nutritifs plus fortes.
|
a |
b |
Figure 16 : Simulations pour la station N12, du 04/04/02 au 03/06/02. A gauche : variations du carbone et de l’azote détritique ; à droite : variations de l’ammonium et de l’azote organique dissous (NOD). Toutes les variables sont exprimées en µmol/l.
La matière organique détritique et l’azote organique dissous montrent les mêmes tendances qu’en M33 (Figure 16-a et Figure 16-b). En revanche, l’ammonium se distingue par une décroissance immédiate dès le début de la simulation (Figure 16-b), suivie par une croissance du même type que pour la station M33.
|
a |
b |
Figure 17 : Simulations pour la station N12, du 04/04/02 au 03/06/02. A gauche : production bactérienne (106 cell/l/h) et chlorophylle a (µg/l) ; à droite : équivalent, mais " zoomé " sur la gamme de variations de la production bactérienne
La dynamique de la production bactérienne est également du même type que celle de M33 (Figure 17-a et Figure 17-b). On note cependant que la valeur autour de laquelle la production bactérienne vient se stabiliser est légèrement supérieure.
Une simulation fictive a été réalisée afin de mettre en évidence le rôle joué par le NOD.
Les conditions initiales à la station M33 ont été modifiées : la concentration initiale en NOD est établie à 2.0 µmol/l au lieu de 5 µmol/l, ce qui va provoquer son annulation au cours de la simulation.
Les résultats de cette simulation sont présentés sur la Figure 18.
|
a |
b |
Figure 18 : Simulation fictive pour la station M33, du 04/04/02 au 03/06/02. A gauche : production bactérienne (106 cell/l/h) et chlorophylle a (µg/l) ; à droite : ammonium et NOD (µmol/l). La concentration initiale en NOD a été diminuée manuellement à 2 µmol/l au lieu de 5.
Le NOD décroît régulièrement, pour s’annuler à partir du 16/05/02 (Figure 18-b). Cette annulation entraîne une forte diminution de l’ammonium, jusqu’à une valeur presque nulle.
Parallèlement, on constate une nette chute de la production bactérienne le 16/05/02 (Figure 18-a). La production se maintient alors à une valeur extrêmement faible (environ 3,2 106 cell/l/h) jusqu’à la fin de la simulation.
Il est important de garder à l’esprit que ce premier modèle biogéochimique incluant les processus bactériens dans le lagon de Nouméa est sans dimension. Si ce choix permet d’étudier le comportement du modèle et d’en comparer la dynamique à celle du modèle initial, il affecte bien entendu la comparaison des valeurs simulées avec les mesures in situ.
La caractéristique remarquable du modèle sans dimension est sa stabilité. Aucune variable ne diverge, et les valeurs de chacune des variables observées sont réalistes si on les compare aux mesures réalisées dans le lagon.
Nous allons étudier le comportement de chacune des variables. La faible sensibilité du modèle vis à vis des conditions initiales nous incite à discuter les résultats par compartiment biogéochimique, en regroupant les résultats des deux stations M33 et N12.
Phytoplancton
La Figure 11-b met en évidence l’alternance jour-nuit de la croissance du phytoplancton, et montre que la limitation par la lumière est correctement simulée. En outre, l’étude de la courbe de l’azote phytoplanctonique (NB) permet de comprendre le fonctionnement du principe de quota cellulaire : l’uptake d’azote peut s’effectuer de nuit, mais l’absence de production durant la nuit entraîne très vite une saturation des cellules phytoplanctoniques en azote, et donc un uptake très faible ; c’est pourquoi on observe un léger décalage entre les courbes de CB et NB.
Pour les deux stations, on constate une augmentation de la biomasse phytoplanctonique en début de simulation : cette augmentation traduit une production primaire forte, rendue possible par des quantité d’ammonium non limitantes. La chute de cette biomasse est liée à la diminution de l’ammonium, qui ne suffit plus à satisfaire les besoins du phytoplancton. Malgré l’augmentation de l’ammonium à partir du 11/04/02, la production primaire ne parvient pas à se relancer.
En fin de simulation, plusieurs jours de rayonnement faible provoquent la diminution de la production primaire, en raison d’une limitation par la lumière. Ces périodes de faible ensoleillement sont : du 9 au 12 Mai, du 21 au 24 Mai, du 28 au 29 Mai (cf. Figure 11-a). La concentration en ammonium augmente alors, en raison d’une consommation plus faible par le phytoplancton; le retour d’un ensoleillement suffisant permet au phytoplancton de redémarrer sa croissance. Ces variations de lumière sont responsables des " bosses " observées sur les courbes de la biomasse phytoplanctonique et de l’ammonium.
Matière organique détritique
La consommation de matière détritique est très forte, comparée à sa production, ce qui provoque sa chute irréversible.
Cette consommation est due essentiellement à la consommation par les bactéries des produits de dégradation, ainsi qu’à l’ingestion par le zooplancton. Des processus de production manquent au modèle dans l’état actuel, comme les apports par les fleuves ou par les échelons trophiques supérieurs.
Le modèle n’étant pas limité en carbone, l’annulation du carbone détritique particulaire a peu d’implications sur le fonctionnement global.
En revanche, la brusque diminution de l’azote détritique particulaire est responsable de la chute d’ammonium entre le 07/04/02 et le 11/04/02. En effet, le niveau important d’ammonium au début de la simulation était maintenu par la régénération de l’azote détritique par le zooplancton.
Matière organique dissoute
La consommation de COD est très importante, en raison de la respiration forte (due au faible rendement de croissance) des bactéries. La concentration en COD s’annule au bout d’un mois de simulation. La production par le phytoplancton et zooplancton ne permet donc pas de satisfaire la demande en carbone des bactéries : des processus d’apports devront être pris en compte dans le modèle afin de pouvoir correctement simuler le carbone dissous.
Il est en effet nécessaire de considérer les apports allochtones de Matière Organique Dissoute (fleuves), ainsi que les échanges de matière organique à l’interface eau-sédiment (Christian et Anderson, 2002).
En outre, il faut noter qu’il existe une incertitude considérable sur la valeur moyenne du PER (Percent Extracellular Release) du phytoplancton, en raison de la difficulté des techniques de mesure (Christian et Anderson, 2002). Nous avons arbitrairement fixé ce PER à 6%, une valeur issue de la littérature (Bender et al. 1999). D’autres synthèses font état d’une valeur moyenne plus élevée(25% de la production primaire, (Fasham et al. 1999
Le NOD joue un rôle capital dans la croissance des bactéries, car il permet à celles-ci de subvenir à leur besoin en azote malgré de faibles quantités d’ammonium. La simulation fictive (cf. Figure 18) a mis en évidence cette importance : lorsque le NOD s’annule, la production bactérienne chute jusqu’à des valeurs très faibles, proches de celles mesurées en M33. Il est donc envisageable que le NOD présent dans la colonne d’eau à la station M33 ne soit pas totalement accessible pour les bactéries, ou tout au moins qu’il y aurait des nouveaux processus à prendre en compte, comme l’hydrolyse des polymères.
Nous reviendrons sur la Matière Organique Dissoute dans le prochain chapitre.
Ammonium
Les nombreuses variations de la courbe de l’ammonium (NH) sont expliquées par deux processus : l’uptake du phytoplancton et sa reminéralisation par la boucle microbienne.
La brusque augmentation de l’ammonium provient de la forte concentration initiale en azote détritique particulaire(NP) : NP est reminéralisé à travers l’ingestion par le zooplancton, et la consommation des bactéries des produits de dégradations. Cette augmentation permet au phytoplancton de se développer : lorsque la quantité de matière particulaire est trop faible pour assurer une reminéralisation suffisante, l’ammonium chute, consommé par le phytoplancton et les bactéries.
A partir du 11/04/02, l’ammonium se stabilise, et augmente régulièrement. Cette stabilisation résulte de l’équilibre de NP ainsi que de la forte diminution du phytoplancton, dont la demande en azote est plus faible.
Bactéries
La présence d’ammonium et de NOD provoque la brusque augmentation de la production bactérienne, qui n’est pas limitée. Cette production se stabilise pour maintenir un quota cellulaire N/C d’environ 0,18 (pour M33 et N12). A partir de plusieurs tests de sensibilité, on a pu constater que la valeur de ce quota cellulaire final dépend des paramètres contrôlant la croissance des bactéries. Ce quota cellulaire de stabilisation étant le même pour M33 et N12, la production bactérienne plus forte en N12 est expliquée par une abondance bactérienne plus élevée.
Durant la suite de la simulation, la production bactérienne suit les variations de l’ammonium, mais en restant dans une gamme étroite de valeurs élevées, en raison de la présence permanente du NOD dans le système.
Conclusion
Pour chaque simulation, le modèle commence, dans une première phase, par s’affranchir des conditions initiales. Il atteint alors une situation d’équilibre entre les processus biogéochimiques. Cet équilibre est déterminé par la paramétrisation des processus simulés, sans forçage extérieur par les processus physiques. A partir de cette situation d’équilibre, le modèle va être contrôlé par les variables dont les apports ne sont pas suffisants pour compenser leur consommation, et par le forçage dû à la lumière. Le modèle fonctionne alors sur le principe de régénération. Ce fonctionnement n’est pas perturbé par le de forçage physique.
La dynamique biogéochimique globale se retrouve dans les résultats des deux modèles. Cependant, les processus de reminéralisation sont plus finement décrits dans ce nouveau modèle, qui prend en compte l’ensemble des étapes de régénération.
Dans le modèle initial, la production d’ammonium était effectuée à partir de l’azote détritique particulaire, à l’aide d’un coefficient constant. Le nouveau modèle introduit une production d’ammonium par le zooplancton : cette production prend en compte l’ingestion opportuniste de biomasse par le zooplancton, et sera donc dépendante de l’état global du système, et pas uniquement de la concentration en azote détritique.
L’introduction de la boucle microbienne entraîne une compétition entre les bactéries et le phytoplancton pour l’ammonium. Cette compétition affecte essentiellement le phytoplancton, car les bactéries ont la possibilité de subvenir à leur besoins en azote grâce au NOD.
Cette compétition limite la croissance du phytoplancton dans le nouveau modèle : les valeurs de la biomasse phytoplanctonique sont plus faibles. Les valeurs d’ammonium sont également plus faibles, mais la régénération est plus efficace dans le nouveau modèle : après la stabilisation du système, l’ammonium suit une courbe croissante plus forte que dans le modèle initial.
Les valeurs des variables biologiques issues de la simulation sont généralement éloignées de celles mesurées sur le terrain.
En M33, la production bactérienne est extrêmement faible, et ne parvient pas à augmenter durant toute la période de mesure : les valeurs de la simulation sont beaucoup plus élevées (10 fois plus). En N12, les valeurs de production de la simulation sont plus proches des valeurs mesurées, mais l’écart reste important (25% de plus pour la simulation). Cet écart doit cependant être relativisé, étant donné l’interprétation difficile des mesures de production bactérienne.
Les variables du phytoplancton simulées sont à l’inverse plus proche des mesures en M33 (la chlorophylle a mesurée ne dépasse jamais les 0,4 µg/l). En N12, on note un écart important entre les valeurs maximales de la chlorophylle a simulées (1µg/l) et mesurées (2,25 µg/l). La valeur faible du modèle peut être facilement expliquée par l’absence des apports anthropiques (présence d’un émissaire dans la baie de Sainte-Marie).
Cependant, ces valeurs simulées restent des valeurs réalistes pour le lagon, à chacune des deux stations. Des valeurs de production bactérienne et phytoplanctonique comparables à celles simulées en M33 ont déjà été mesurées à une station similaire (M05, également située dans le chenal lagonaire) en conditions de moindre forçage par les vents (Jacquet, 2001).
En revanche, les dynamique entre le modèle et les données de terrain ne sont pas comparables.

Figure 19 : Modèle de circulation des eaux lagonaires induites par le vent . Vent de 12 m.s-1 direction 150°
La campagne de mesure d’Avril-Mai 2002 s’est caractérisée par un forçage très important du vent, entraînant une circulation active des masses d’eau vers le nord du lagon. Cette circulation entraîne un renouvellement des eaux lagonaires par les eaux océaniques très oligotrophes. Ce renouvellement peut être extrêmement rapide. Un alizé de Sud Est établi de 12 m/s (valeur inférieure à celles observées en Avril-Mai) entraîne ainsi un temps de renouvellement moyen des eaux lagonaires de 5 jours (Bujan, 2000). Le lagon devient ainsi rapidement très oligotrophe. Une carte de courant pour un vent de 12 m/s et de direction 150°, établie à partir du modèle 3D de P.Douillet est présentée sur la Figure 19.
Notre modèle est une boîte fermée dans laquelle nous avons introduit les conditions initiales relativement oligotrophes du lagon, mais en y retirant les conditions forçantes. Son comportement est donc éloigné des mesures, mais il reste néanmoins tout à fait cohérent.
Ce modèle sans dimension a permis d’ajouter au modèle existant des variables indispensables à la description des cycles biogéochimiques du lagon SW de Nouvelle Calédonie. Les équations et le paramétrage de ces nouveaux processus ont pu être établis, en s’affranchissant de la lourdeur d’un modèle à trois dimensions.
Les mesures de terrain ont permis de mettre en évidence les limites de cette approche " sans dimension ", ainsi que les insuffisances du paramétrage actuel.
Ces modifications des communautés constituent un des intérêts de ce milieu, situé à la frontière entre oligotrophie et mésotrophie. Les changements " qualitatifs " des communautés en fonction de la richesse du lagon sont fréquents et importants, comparés à d’autres milieux côtiers plus eutrophes où un enrichissement en nutriments ne provoquera que des modifications quantitatives (stocks et flux).
La principale structure biologique à ajouter aux modèles biogéochimiques est la fraction semi-labile de la MOD (Christian et Anderson, 2002). Une telle fraction a déjà été utilisée dans certains modèles (Billen et Becquevort, 1991), et peut jouer un rôle important sur la croissance des bactéries. Dans notre modèle, cette fraction pourrait apporter une nouvelle limitation de la croissance des bactéries.
On a pu voir que l’uptake de NOD par les bactéries était un paramètre sensible du modèle. Des mesures d’uptake de NOD dans le milieu considéré seraient donc nécessaires, afin de mieux paramétrer la consommation de NOD par les bactéries.
Un autre paramètre sensible est le coefficient de partage entre l’uptake de NOD et d’ammonium par les bactéries. Le modèle de Fasham et al. (1990) propose une formulation à partir de l’efficacité de croissance bactérienne et des rapports N/C des bactéries et de la MOD. Des mesures seraient donc encore une fois importantes afin d’affiner ce paramètre.
L’intégration au modèle de processus nouveaux est également envisageable : un puits possible de COD est la photominéralisation (COD vers CID) dont l’ordre de grandeur pourrait être équivalent à la photolyse des monomères et la respiration des bactéries s’ensuivant (Miller et Moran, 1997). Les virus jouent également un rôle dans la production de MOD par leur activité lytique et pourraient soutenir la production de MOD dans le modèle.
Cependant, le nombre restreint de mesures réellement quantitatives des différents processus mis en śuvre, ainsi que notre compréhension limitée des interactions entre les communautés microbiennes (Nagata, 2000), et de la physiologie des bactéries hétérotrophes (Kirchman, 2000), limitent les possibilités des modèles numériques (Christian et Anderson, 2002). L’évolution du modèle doit donc passer par une étape importante de mesures sur le lagon de Nouvelle Calédonie, et une meilleure connaissance des processus mis en jeu.
Au cours de ce stage, nous avons essayé d’utiliser au maximum les connaissances et données acquises sur le lagon. Les travaux réguliers en cours sur le lagon sont donc une excellente opportunité de coupler modélisation et expérimentations. L’expérimentation permet de combler les insuffisances de la paramétrisation, trop souvent effectuée à partir de données issues de la littérature. En retour, la modélisation permet de mettre en évidence les processus clefs, nécessaires à la compréhension du fonctionnement global du système.
Baines S.B., Pace M.L. (1991) The production of dissolved organic matter by phytoplankton and its importance to bacteria : Patterns across marine and freshwater systems. Limnol. Oceanogr. 36 : 1078-1090
Bender M., Orchardo J., Dickson M.L., Barber R., Lindley S. (1999) In vitro O2 fluxes compared with 14C production and other rates terms during JGOFS Equatorial Pacific experiment. Deep-Sea Res. (1 Oceanogr. Res. Pap.) 46-4 : 637-654
Billen G. (1991) Protein degradation in aquatic environments. In Microbial enzymes in aquatic environments (edited by Chrost R., Springer), chapter 7 : 122-142
Billen G., Becquevort S. (1991) Phytoplankton-bacteria relationship in the Antarctic marine ecosystem. In Proceedings of the Pro Mare Symposium on Polar Marine Ecology (E. Sakshaug, C.C.E. Hopkins, and N.A. Oritsland, Eds), Polar Res. 10 : 245-253
Binet D. ,Le Borgne R. (1996) The coastal station of Noumea: ten years of observations about the hydrology and pelagos of the south-west lagoon of New-Caledonia. Arch. Sci. Mer Oceanogr. Biol. Mar. Cent. Noumea ORSTOM, ORSTOM, Noumea (France) 37 pp
Bujan S. (2000) Modélisation Biogéochimique du cycle du carbone et de l’azote dans les écosystèmes côtiers tropicaux sous influences terrigène et anthropique, application au lagon de Nouméa (Nouvelle-Calédonie). Thèse de doctorat de l’Université d’Aix – Marseille II. 204 pp.
Bujan S., Grenz C., Fichez R., Douillet P. (2000) Evolution saisonnière du cycle biogéochimique dans le lagon sud-ouest de Nouvelle-Calédonie. Application d’un modèle compartimental. C.R. Acad. Sci. Paris, Sciences de la Vie, 323 : 225-233
Caperon J., Meyer J. (1972) Nitrogen-limited growth of marine phytoplancton. I. Changes in population characteristics with steady state growth rate. Deep-Sea Res. 19A : 601-618
Carlson C.A., Ducklow H.W., Hansell D.A., Smith W.O. (1998) Organic carbon partitioning during spring phytoplankton blooms in the Ross Sea polynya and the Sargasso Sea. Limnol Oceanogr. 43 : 375-386
Caron D.A., Peele E.R., Lim E.L., Dennett M.R. (1999) Picoplankton and nanoplankton and their trophic coupling in surface waters of the Sargasso Sea south of Bermuda. Limnol. Oceanogr. 44 : 259–272
Cho B.C., Azam F. (1988) Major role of bacteria in biogeochemical fluxes in the ocean’s interior. Nature 332 : 441-443
Copping, A.E., Lorenzen,C.J. (1980) Carbon budget of a marine phytoplankton-herbivore system with carbon-14 as a tracer. Limnol. Oceanogr. 25-5 : 873-882
Christian J.R., Anderson T.R. (2002) Modeling Dissolved Organic Matter in the ocean. In Biogeochemistry of marine dissolved organic matter (DA Hansell, CA Carlson, eds.) Academic Press chapter 16 : 717-756
Dagg, M.J. (1976) Complete carbon and nitrogen budgets for the carnivorous amphipod, Calliopius laeviusculus (Kroyer). Int. Rev. Gesamt. Hydrobiol. 61-3 : 297-357
Del Giorgio P., Cole J.J. (1998) Bacterial growth efficiency in natural aquatic systems. Annu. Rev. Ecol. Syst. 29 : 503-541
Douillet P. (1998) Tidal dynamics of the south-west lagoon of New Caledonia : observations and 2D numerical modelling. Oceanol. Acta. 21 : 69-79
Douillet P., Ouillon S., Cordier E. (2001) A numerical model for fine suspended sediment transport in the southwest lagoon of New Caledonia. Coral Reefs 20 : 361-372
Fasham M.J.R., Ducklow H.W., McKelvie S.M. (1990) A nitrogen-based model of plankton dynamics in the oceanic mixed layer. J. Mar. Res. 48 : 591-639
Fasham M.J.R., Boyd P.W., Savidge G. (1999) Modeling the relative contributions of autotrophs and heterotrophs to carbon flow at a Lagrangian JGOFS station in the Northeast Atlantic: the importance of DOC. Limnol Oceanogr. 44 : 80-94
Fuhrman J.A. (1999) Marine viruses and their biogeochemical and ecological effects. Nature 399 : 541–548
Fuhrman J.A., Sleeter T.D., Carlson C.A., Proctor L.M. (1989) Dominance of bacterial biomass in the Sargasso Sea and its ecological implications. Mar. Ecol. Prog. Ser. 57 : 207-218.
Fukuda R., Ogawa H., Nagata T., Koike I. (1998) Direct determination of carbon and nitrogen content of natural bacterial assemblages in marine environments. Appl. Environ. Microbiol. 64: 3352-3358
Gerber R.P., Gerber M.B. (1979) Ingestion of natural particulate organic matter and subsequent assimilation, respiration and growth by tropical lagoon zooplankton. Mar. Biol. 52-1: 33-43
Goosen N.K., Vanrijswijk P., Debie M., Peene J., Kromkamp J. (1997) Bacterioplankton abundance and production and nanozooplankton abundance in Kenyan coastal waters (Western Indian Ocean). Deep-Sea Res. 44 : 1235–1250
Harmon R., Challenor P. (1997) A Markov chain Monte Carlo method for estimation and assimilation into models. Ecol. Mod. 101 : 41-59
Heldal M., Norland S., Fagerbakke K.M., Thingstad F., Bratbak G. (1996) The elemental composition of bacteria: a signature of growth conditions? Mar. Poll. Bull. 33 : 3-9
Jacquet, S. (2001) Importance comparée des biomasses et productions bactérienne et primaire planctoniques et leurs relations avec les variables physico-chimiques dans le Lagon Sud-Ouest de Nouvelle-Calédonie. Rapport de DEA de l’Université Pierre et Marie Curie - Paris VI, option " environnement marin et biogeochimie " 31 pp. + annexes
Jürgens K., Gasol J., Vaqué D. (2000) BacteriaŻflagellate coupling in microcosm experiments in the Central Atlantic Ocean. J. Exp. Mar. Biol. Ecol. 245 : 127-147
Kérouel R., Aminot A. (1997) Fluorometric determination of ammonia in sea and estuarine waters by direct segmented flow analysis. Mar. Chem. 57 : 265-275
Kirchman D.L. (1994) The uptake of inorganic nutrients by heterotrophic bacteria. Microb. Ecol. 28 : 255-271
Kirchman D.L. (1990) Limitation of bacterial growth by dissolved organic matter in the subarctic Pacific. Mar. Ecol. Prog. Ser. 62 : 47–54
Kirchman D.L. (2000) Uptake and regeneration of inorganic nutrients by marine heterotrophic bacteria. In Microbial Ecology of the Oceans (edited by DL Kirchman), chapter 9 : 261-288
Kirchman D.L., Rich J.H. (1997) Regulation of bacterial growth rates by dissolved organic carbon and temperature in the equatorial Pacific Ocean. Microb. Ecol. 33 : 11–20
Kremer P. (1978) Respiration and excretion by the ctenophore Mnemiopsis leydyi. Mar. Biol. 44 : 43-50
Labrosse P., Fichez R., Farman R., Adams T. (2000) New Caledonia. In Seas at the Millenium, an environmental evaluation. Sheppard C. (ed.), Elsevier, Amsterdam. Vol. 2, p. 723-736.
Landry M.R, Constantinou J., Kirshtein J. (1995) Microzooplankton grazing in the central equatorial Pacific during February and August, 1992. Deep-Sea Res. 42 : 657–671
Le Borgne R. (1978) Evaluation de la production secondaire planctonique en milieu océanique par la méthode des rapports C/N/P. Oceanol. Acta 1 : 107-118
Le Borgne R., Roger C. (1983) Caractéristiques de la composition et de la physiologie des peuplements hauturiers de zooplancton et micronecton du Golfe de Guinée. Océanographie tropicale XVIII (2) : 381-418
Le Borgne R. (1986) The release of soluble end products of metabolism. In The biological Chemistry of Marine Copepods (edited by Corner E.D.S & O’HARA S.C.M, Oxford University Press) Chapter 3 :109-164
Le Borgne R., Blanchot J., Charpy L. (1989) Zooplankton of the atoll of Tikehau (Tuamotu Archipelago) and its relations with particulate matter. (Le zooplancton de l'atoll de Tikehau (archipel des Tuamotu) et ses relations avec la matière particulaire). Mar. Biol. 102 : 341-353
Le Borgne R., Rodier M., Le Bouteiller A., Kulbicki M. (1997) Plankton biomass and production in an open atoll lagoon : Uvea, New Caledonia. J. Exp. Mar. Biol. Ecol. 212 : 187-210
Lee S., Fuhrman J.A. (1987) Relationship between biovolume and biomass of naturally derived marine bacterioplankton. Appl. Environ. Microbiol. 53 : 1298-1303
Lynch M., Weider L.J., Lampert W. (1986) Measurement of the carbon balance in Daphnia. Limnol. Oceanogr. 31 : 17-33
Miller W.L., Moran M.A. (1997) Interaction of photochemical and microbial processes in the degradation of refractory dissolved organic matter from a coastal marine environment. Limnol. Oceanogr. 42 : 1317-1324
Murphy J., Riley J.P. (1962) A modified single solution method for the determination of phosphate in natural waters. Anal. Chim. Acta. 27 : 31-36
Nagata T. (2000) Production mechanisms of Dissolved Organic Matter. In Microbial Ecology of the Oceans (edited by DL Kirchman), chapter 5 : 121-152
Panikov N.S. (1995) Microbial Growth Kinetics. Chapman and Hall, London
Pinazo C., Marsaleix P., Millet B., Estournel C., Kondrachoff V., Véhil R. (2001) Phytoplankton Variability in Summer in the Northwestern Mediterranean: Modelling of the Wind and Freshwater Impacts. J. Coastal Res. 17-1 : 146-161
Pinazo C., Marsaleix P., Millet B., Estournel C., Véhil R. (1996) Spatial and temporal variability of phytoplankton biomass in upwelling areas of the northwestern Mediterranean : a coupled physical and biogeochemical modelling approach. J. Marine Syst. 7 : 161-191
Porter K.G., Feig Y.S. (1980) The use of DAPI for identifying and counting aquatic microflora. Limnol. Oceanogr. 25 : 943-948
Raimbault P., Slawyk G., Coste B., Fry J. (1990) Feasibility of using an automated colorimetric procedure for the determination of seawater nitrate in the 0 to 100 nM range : examples from field and culture. Mar Ecol. Prog. Ser. 104 : 347-351
Small L.F., Fowler S.W., Moore S.A., Rosa J. (1983) Dissolved and fecal pellet carbon and nitrogen release by zooplankton in tropical waters. Deep-Sea Res. 30 : 1199-1220
Steemann-Nielsen E. (1951) Measurement of the production of the organic matter in the sea by mean of carbon 14. Nature 86 : 103-110
Steinberg D.K., Carlson C.A., Bates N.R., Goldthwait, S.A., Madin L.P., Michaels A.F. (2000) Zooplankton vertical migration and the active transport of dissolved organic and inorganic carbon in the Sargasso Sea. Deep-Sea Res. 47 : 137-158
Strom L. (2000) Bacterivory : interactions between bacteria and their grazers. In Microbial Ecology of the Oceans (edited by DL Kirchman), chapter 12 : 351-386
Tett P. (1987) Modelling the growth and distribution of marine microplankton. Soc. Gen. Microbiol. Symp. 41 : 387-425
Thingstad F. (1987) Utilization of N, P and organic C by heterotrophic bacteria. I. Outline of a chemostat theory with a consistent concept of 'maintenance' metabolism. Mar. Ecol. Prog. Ser. 35 : 99-109.
Torréton J.P., Dufour P. (1996) Bacterioplankton production determined by DNA synthesis, protein synthesis, and frequency of dividing cells in Tuamotu atoll lagoons and surrounding ocean. Microb. Ecol. 32 : 185-202
Weisse T. (1989) The microbial loop in the Red Sea : dynamics of pelagic bacteria and heterotrophic nanoflagellates. Mar. Ecol. Prog. Ser. 55 : 241–250
Williams P.J. LeB. (2000) Heterotrophic bacteria and the dynamics of dissolved organic material. In Microbial Ecology of the Oceans (edited by DL Kirchman), chapter 6 : 153-200
Index des figures
Figure 1 : Lagon Sud-Ouest de la Nouvelle-Calédonie
*Figure 2 : Stations du suivi saisonnier
*Figure 3 : Modèle biogéochimique initial (cf. Tableau 1 pour la légende)
*Figure 4 : Modèle biogéochimique, intégrant la boucle microbienne (cf. Tableau 1 pour la légende)
*Figure 5 : Effets d’enrichissements après 48h en N-NH4 (vert), P-PO4 (bleu), C-Glucose (gris) et N+P (rayés) comparés aux contrôles (blanc) en 3 stations du lagon de Nouméa. A gauche : Production bactérienne (pM TdR/h), à droite : Chlorophylle a (µg/l). Les barres d’erreurs représentent les erreurs standard sur des réplicats (novembre 2000, Torréton et al. non publié).
*Figure 6 : Temps (h) de turn-over du phosphate en fonction des temps de turn-over de l’ammonium à différentes stations du lagon de Nouméa (triangles : novembre 2000, ronds : juillet 2001). La droite représente l’égalité (Torréton et al. non publié).
*Figure 7 : Uptake maximum de NH4 (nM/h) dans la classe de taille < 0,6 µm en fonction de l’incorporation de thymidine (pM/h) (Torréton, non publié). La filtration sur membrane Nuclepore de porosité 0,6 µm est faite après incubation. La pente est corrigée du pourcentage de bactéries retenues par la membrane 0,6µm, du coefficient de conversion de la TdR en nombre de cellules (Jacquet, 2001), et du contenu en azote par cellule (Fukuda et al. 1998). Barres d’erreurs = écart-types.
*Figure 8 : Rayonnement total journalier à Nouméa, du 01/04/02 au 02/06/02 (données intégrées sur la journée et centrées sur 12h)
*Figure 9 : Variations de la production bactérienne (106 cell/l/h) et de la chlorophylle a (µg/l) du 04/04/02 au 03/06/02, pour les stations M33 et N12.
*Figure 10 : Variations de l’ammonium (µM/l) du 04/04/02 au 03/06/02, pour les stations M33 (a) et N12 (b). Barres d’erreurs : écart-types sur 4 réplicats.
*Figure 11 : Variations du carbone et de l’azote phytoplanctonique, pour la station M33. à gauche : simulation du 04/04/02 au 03/06/02 ; à droite : simulation du 04/04/02 au 06/04/02. CB et NB en µmol/l.
*Figure 12 : Simulations pour la station M33, du 04/04/02 au 03/06/02. A gauche : variations du carbone et de l’azote détritique ; à droite : variations de l’ammonium et de l’azote organique dissous (NOD). Toutes les variables sont exprimées en µmol/l.
*Figure 13 : Simulations pour la station M33, du 04/04/02 au 03/06/02. A gauche : production bactérienne (106 cell/l/h) et chlorophylle a (µg/l) ; à droite : équivalent, mais " zoomé " sur la gamme de variations de la production bactérienne.
*Figure 14 : Simulations avec le modèle initial pour la station M33, du 04/04/02 au 03/06/02. A gauche : variations du carbone et de l’azote phytoplanctonique ; à droite : variations de l’ammonium et de l’azote détritique particulaire. Toutes les variables sont exprimées en µmol/l.
*Figure 15 : : Variations du carbone et de l’azote phytoplanctonique, pour la station N12. à gauche : simulation du 04/04/02 au 03/06/02 ; à droite : simulation du 04/04/02 au 06/04/02. CB et NB en µmol/l.
*Figure 16 : Simulations pour la station N12, du 04/04/02 au 03/06/02. A gauche : variations du carbone et de l’azote détritique ; à droite : variations de l’ammonium et de l’azote organique dissous (NOD). Toutes les variables sont exprimées en µmol/l.
*Figure 17 : Simulations pour la station N12, du 04/04/02 au 03/06/02. A gauche : production bactérienne (106 cell/l/h) et chlorophylle a (µg/l) ; à droite : équivalent, mais " zoomé " sur la gamme de variations de la production bactérienne
*Figure 18 : Simulation fictive pour la station M33, du 04/04/02 au 03/06/02. A gauche : production bactérienne (106 cell/l/h) et chlorophylle a (µg/l) ; à droite : ammonium et NOD (µmol/l). La concentration initiale en NOD a été diminuée manuellement à 2 µmol/l au lieu de 5.
*Figure 19 : Modèle de circulation des eaux lagonaires induites par le vent . Vent de 12 m.s-1 direction 150°
*
Index des tableaux
Tableau 1 : Variables d'état du modèle
*Tableau 2 : paramètres du modèle. Exp : Données expérimentales sur le lagon de Nouméa. Litt : données issues de la littérature.
*Tableau 3 : Conditions initiales en M33 et N12. Exp : Données expérimentales sur le lagon de Nouméa. Litt : données issues de la littérature
*
Remerciements
Je tiens tout d’abord à remercier chaleureusement mes deux responsables de stage, Christel PINAZO et Jean-Pascal TORRETON pour leur encadrement pendant ces quatre mois, leur disponibilité, leur engagement et leur bonne humeur !
Je remercie tout particulièrement Renaud FICHEZ pour m’avoir accueilli au sein de l’Unité de Recherche CAMELIA, ainsi que Christian GRENZ, pour son aide importante dans la mise en place de ce stage.
Merci à Séverine JACQUET pour toutes les données indispensables fournies durant ce stage, ainsi que pour m’avoir fait participer à sa campagne de mesure.
Un grand merci à Robert LE BORGNE pour son aide précieuse concernant le zooplancton, et Aubert LEBOUTEILLER, pour son aide sur le phytoplancton.
Je remercie Sandrine CHIFFLET, Philippe GERARD, et Alain LAPETITE pour la réalisation des analyses physico-chimiques.
Je remercie Pascal DOUILLET et Sylvain OUILLON pour m’avoir fait bénéficier de leurs connaissances en courantologie.
Merci à Olivier PRINGAULT, pour sa relecture pertinente du rapport.
Merci à Patrick RAIMBAULT pour ses analyses rapides de la matière organique particulaire, à Gustave CAUWET pour ses analyses de la matière organique dissoute.
Merci à Vianney et Tho pour leur correction de mon anglais parfois approximatif !
Je remercie maintenant toutes les personnes que ce stage m’a permis de rencontrer : les stagiaires du " loft " de Nouméa, Florian, Aurélien, Violaine, Carole, Julie, Denis, Mathieu, Aurore, Jorge, Thierry, Nora et Victor ; les thésards du COM, Estelle, Bruno et Sam. Merci à vous tous pour votre soutien et pour tous les bons moments passés ensemble !